Clinical assessment of mocravimod as a victim of drug–drug interactions via CYP3A4 metabolism and transporters
Clinical assessment of mocravimod as a victim of drug–drug interactions via CYP3A4 metabolism and transporters
Dymphy R. Huntjens, Stephan Oehen, and Elisabeth Kueenburg
Abstract
Mocravimod, a novel immunomodulator targeting sphingosine-1-phosphate receptor (S1PR), is being developed as a maintenance treatment for patients with acute myeloid leukemia undergoing allogeneic hematopoietic cell transplantation. Preclinical data suggested that cytochrome (CYP) 3A4 is the primary enzyme involved in mocravimod metabolism. In vitro data showed that both mocravimod and its active metabolite mocravimod-phosphate are substrates for breast cancer resistance protein (BCRP) and P-glycoprotein (P-gp) but not for organic-anion-transporting polypeptides (OATP1B1 and OATP1B3). As mocravimod is co-administered with CYP3A4 inhibitors such as azoles or cyclosporin, the potential for drug–drug interactions (DDIs) was evaluated. In addition, the effect of BCRP, P-gp, and OATP via cyclosporin coadministration was assessed. Two open-label, two-period, fixed-sequence studies were conducted in healthy subjects to evaluate the DDI potential of mocravimod and 1) itraconazole, a dual CYP3A4/P-gP inhibitor, or 2) cyclosporin, a moderate inhibitor of CYP3A4 and P-gp, BCRP, OATP1B1, and OATP1B3. Safety and tolerability were also monitored. The PK of mocravimod and mocravimod-phosphate were bioequivalent with or without co-administration of multiple doses of itraconazole and a moderate interaction is observed when co-administered with cyclosporin. The most commonlyreported treatment-emergent adverse events were bradycardia and decreased lymphocyte count, which are expected side effects for S1PR modulators.
Keywords: cyclosporine, drug–drug interaction, immunomodulator, itraconazole, pharmacokinetics
Mocravimod is a novel sphingosine-1-phosphate receptor (S1PR) modulator developed as a maintenance treatment for patients with acute myeloid leukemia (AML) undergoing allogeneic hematopoietic cell transplantation (allo-HCT). Allogeneic HCT is a standard curative treatment for AML. Allogeneic HCT, which comprises the elimination of the patient’s bone marrow, usually by means of myeloablative conditioning involving high-dose chemotherapy and possibly total body irradiation, followed by transplantation of donor hematopoietic cells, is used to treat AML. All patients undergo conditioning before HCT as part of required standard of care treatment before allo-HCT.1
The major limitation for successful outcome of allogeneicHCT is disease relapse. Graft-versus-leukemia (GvL) is critical to prevent disease relapse and is mediated by donor T cells contained in the HCT graft that trigger immune responses against leukemic cells. The off-target effect of the desirable GvL effect—graft-versus-host disease (GvHD)—remains a major complication of HCT. The standard of care for preventing GvHD is prophylactic treatment of cyclosporin or Tacrolimus, given as IV or oral formulation for months post-transplant.
In USA, mostly tacrolimus is used, whereas in Europe cyclosporin is used.1 As standard of care, azoles such as itraconazole are given as prophylactic treatment to prevent or treat infections. In general for up to 1-year post-transplant as prophylaxis. Mocravimod is an S1P receptor (S1PR) modulator that blocks lymphocyte egress from lymphoid organs via its phosphorylated active metabolite, mocravimod-phosphate. This results in co-localization of effector lymphocytes with residual leukemia cells, potentially augmenting GvL, and simultaneously reduction of circulating lymphocytes that can mediate GvHD.
S1PR modulation does not interfere with T cell cytotoxicity, hence function is maintained, and anti-leukemia response remains potent.2 Mocravimod’s potential to preserve the desirable GvL effect while decreasing GvHD is a promising way to maintain the prospect of a cure while decreasing transplantrelated mortality (TRM) and morbidity in AML patients undergoing allogeneic HCT. In the current ongoing phase 3 study for the allo-HCT, several conditioning regimens are allowed such as combinations of busulphan, treosulphan, melphalan, fludarabine, clofarabine, cytarabinem etoposide, cyclophosphamide, carmustine, and/or thiotepa – that are required to eliminate the bone marrow by conditioning via high-dose chemotherapy and then proceed to stem cell transplant via donor cells.
All patients undergoing allo-HCT receive prophylaxis against fungal and bacterial infections. Anti-fungal and some antibiotic medications are CYP3A4 inhibitors. Calcineurin inhibitors, such as cyclosporine A, are key forGvHD prophylaxis in patients undergoing allo-HCT. Mocravimod (1 and 3 mg once daily, o.d.) is under study to be administered concomitantly with these standard of care treatments such as azole anti-fungals (CYP3A4 inhibitors) and immunosuppressants, for example cyclosporin in allo-HCT patients. As such, it is important to know, if there are drug–drug interactions that may impact mocravimod and/or mocravimod-phosphate exposure.
Single (0.1–40 mg) and multiple ascending-dose (0.3–3 mg o.d.) studies in healthy subjects demonstrated a favorable safety, tolerability, pharmacokinetic (PK), and pharmacodynamic (PD) profile of mocravimod and mocravimod-phosphate; linear PK was seen following single doses of mocravimod ranging from 2 to 40 mg and absorption was slow with maximum blood concentration (Cmax) reached at a median time of 6 to 12 h post-dose for both mocravimod and mocravimod-phosphate. Blood concentration-time profiles of both compounds showed a slight rebound between 24 to 48 h after dosing indicating the possibility of entero-hepatic recycling.
Tissue distribution was extensive (volume of distribution 3000 to 6000 L) and apparent total clearance (CL/F) was low/moderate (14 to 68 L/h), leading to long elimination half-life values (100 to 130 h). The parent to metabolite ratio is approximately 1 after single and multiple dosing. Food did not have a relevant effect on the rate or extent of absorption. Protein binding is very high for both parent andmetabolite (MOCfu% 0.0404% to 0.0641%, phosphate fu% 0.125% to 0.180%).
Following repeated mocravimod administration to healthy subjects at doses of 0.3 to 3 mg/day, mocravimod and mocravimod-phosphate accumulated substantially (6-fold), with steady state reached after 1 month of dosing. Exposure increased proportionally with the dose. After stop of drug administration, blood concentrations of both compounds declined in parallel confirming a formation-rate limitation in the kinetics of the metabolite.
Based on a study in human hepatocytes which evaluated the fractional contribution of different metabolic pathways to mocravimod clearance,2 oxidative metabolism (70% to 78%, mainly CYP3A4) contributed mainly to the elimination, whereas UGT contributed to a minor part (10% to 12%). Mocravimod phosphate is converted back to mocravimod or it is oxidized only to a very small extent (CYP1A1). Mocravimod was also significantly inhibited in vitro in human liver microsomes by CYP3A4 selective inhibitors ketoconazole (IC50 ∼ 1 μM) and azamulin (IC50 ∼ 0.15 μM).
Consequently, concomitant use of mocravimod with perpetrator drugs that affect hepatic CYP3A4 activity may have significant effects on exposure to mocravimod and/or mocravimod-phosphate.
Renal excretion of both mocravimod and mocravimodphosphate was expected to represent a minor elimination pathway in humans, as no excretion in urine was found. Hence, no drug–drug interaction (DDI) effects at the level of renal transporters were expected.
In vitro data did not suggest that OATP1B1, 1B3, and OCT1 mediated the uptake of mocravimod and mocravimod-phosphate. However, based upon in vitro studies in Madin–Darby canine kidney cells, it was shown that both mocravimod and mocravimodphosphate are substrates for breast cancer resistance protein (BCRP) and P-glycoprotein (P-gp).
Therefore, it is necessary to investigate these potential interactions in accordance with the recommendations of the Food and Drug Administration (FDA)4 and the European Medicines Agency (EMA)5 to assess the potential DDIs6 of mocravimod.
Various S1P modulators, such as fingolimod, cenerimod, ponesimod, siponimod have been shown to slow the heart rate, as a result of S1P binding to multiple receptors including S1P1R.16 Furthermore, fingolimod has been associated with several safety concerns including bradycardia, AV blocks, increased blood pressure and macular edema.7 Based on earlier studies in healthy volunteers, the pharmacodynamic effects of mocravimod included a dose dependent transient reduction in heart rate within the first days after starting treatment and a dose dependent reduction in peripheral lymphocytes (mode of action). With continued daily dosing, the heart rate effect was attenuated and eventually disappeared. In contrast, the reduction in blood lymphocytes is sustained during continuous dosing and is likely explained by persistent internalization of the S1P1 receptor.
In accordance with in vitro findings, two studies (PKRPH001 and PKRPH002) were designed to identify potential drug interactions with mocravimod and mocravimod-phosphate as victims. The objective of these studies was to evaluate the magnitude of the DDIs of mocravimod and mocravimod-phosphate with drugs that affect CYP3A4/P-gP metabolism (itraconazole)8,9 and inhibit CYP3A4, OATP1B1/B3, P-gp, or BCRP transporters (cyclosporin10) in healthy subjects. In addition, the reduction in heart rate was assessed after mocravimod treatment.
Materials and Methods
Ethics
The study protocols, amendments, and informed consent formswere reviewed by an independent ethics committee (Ethic Committee of Ile-de-France VII). These studies were conducted in accordance with the ethical principles in the Declaration of Helsinki and are consistent with International Conference on Harmonisation, Good Clinical Practice, and applicable regulatory requirements. All subjects provided written informed consent for study participation before any procedures were performed. Known instances of nonconformance were documented and are not considered to have had an impact on the overall conclusions of these studies. These studies were conducted from September 2022 throughAugust 2023 at a single site in France (Biotrial).
Study Objectives
The primary objective of these studies was to assess the effects of multiple dosing of a strong CYP3A4 inhibitor (itraconazole) and multiple dosing of a moderate CYP3A4, P-gp, OATP1B1/3 and BCRP inhibitor (cyclosporin) on the single-dose PK of mocravimod and mocravimod-phosphate.
The secondary objectives were to characterize the PK, safety, and tolerability of mocravimod and coadministered drugs in healthy subjects. In addition, the change in pulse rate in presence or in absence of cyclosporin in combination with mocravimod was assessed.
Study Design
The two studies were open-label, two-period, fixed sequence studies conducted in healthhealthy subjects.
Relevant inclusion/exclusion criteria: Subjects were not included if; Participated in any clinical investigation within 4 weeks prior to first dosing or longer if required by local regulations. They had a history of hypersensitivity to any of the study drugs. Subjects who had received any prescription drugs or over the counter medication or herbal supplements within 4 weeks before initial dosing were excluded. Acetaminophen was allowed, if needed. Medical history of cardiovascular findings such as but not limited to: 1st degree atrioventricular (AV)-block, 2nd degree AV-block (type I or II) or 3rd degree AV-block and/or other relevant arrhythmias.
A family history of long QT syndrome. Subjects were excluded when clinically significant ECG findings were found, including QT interval corrected for heart rate using Fridericia’s formula (QTcF) >450 ms for males and >470 ms for females, PR >200 ms, QRS >110 ms. Subjects were included if they had a heart rate between 50–100 bpm in resting supine position.
Itraconazole DDI study (PKRPH002). The study design is displayed in Figure S1. The study consisted of a screening period between 28 and 2 days before the first study treatment administration. On day 1 of period 1 (P1D1), subjects received a single 3 mg oral dose of mocravimod alone in fed conditions. The highest clinical dose of mocravimod currently studied in a phase 3 program is 3 mg o.d. There was a washout of at least 4 weeks and up to a maximum of 6 weeks between the two treatment periods.
From day 1 until day 13 of period 2, itraconazole 200 mg was administered once daily (o.d.) in fed conditions. On day 5 of period 2 (P2D5), subjects received oral mocravimod in fed conditions, 60 min after itraconazole dosing. Doses of 200 mg itraconazole (o.d.) were selected as doses of 200 mg to 400 mg are commonly used in therapy. Itraconazole (200 mg o.d.) administration started 4 days prior to evaluating its DDI effect with mocravimod based on regulatory feedback to ensure sufficient plasma levels of itraconazole were reached to allow for evaluating the inhibitory effect of itraconazole.
A follow-up evaluation was performed at the end-of-study (EOS) visit, 25 ± 2 days after P2D5 or in case of early termination. In period 1 and 2, blood samples were collected for determination of mocravimod and mocravimod-phosphate concentrations at pre-dose and 0.25, 0.5, 1, 2, 4, 6, 8, 10, 12, 24, 36, 48, 72, 96, 120, 144 (period 1 only), 168 (period 2 only), 192, 240, 312, and 360 h (period 2 only) post-dose.
Cyclosporin DDI study (PKRPH001). The study design is displayed in Figure S2. The study consisted of a screening period between 28 days and 2 days before the first study treatment administration. On day 1 of period 1, male subjects received a single oral 3 mg dose of mocravimod alone in fasted conditions. Female subjects were not included in this study based upon request from the study center. The rationale for excluding females was based on the label of cyclosporin where teratogenic effects in animals are described, albeit sufficient safety margin compared to the dose in humans.8
There was a washout period of at least 4 weeks and up to a maximum of 6 weeks between the two treatment periods. From day 1 until day 7 of period 2, cyclosporin 100 mg was administered orally twice daily, in the morning and evening, 12 h apart, in fed conditions, except for the morning doses on days 1 and 2 when oral cyclosporin was administered in fasted conditions. On day 2 of period 2 (P2D2), subjects received 3 mg oral mocravimod in fasted conditions at the same time as the oral cyclosporin morning dose. A follow-up evaluation was performed at the EOS visit, 42 to 49 days after P2D2 or in case of early termination. In periods 1 and 2, blood samples were collected for determination of mocravimod and mocravimodphosphate concentrations at pre-dose and at 0.25, 0.5, 1, 2, 4, 6, 8, 10, 12, 24, 36, 48, 72, 96, 120, 144, 192, 240, 312, and 360 h (period 2 only) post dose.
Sample Size
In a previous study in healthy subjects, the following intra-participant variabilities (percent coefficient of variation [CV%]) for mocravimod were observed for the relevant exposure measures: AUC0–∞ 9% and Cmax 11%. Based on these variabilities, an overall power of 90%, a type 1 error of 5% and allowing for a 5% deviation of the geometric mean ratio (GMR) from the theoretical ratio of 1.0, a projected sample size of 12 participants was calculated to be necessary to be included in the study according to current regulations. Even with a variability of up to 20% in, for example the AUC0–∞ parameter, the power of the study to detect a difference between treatments, if any, was then still >80%. Twenty participants were to be included to allow for the completion of 18 participants and drop-outs were only replaced from the 3rd withdrawn participant to ensure 18 completed participants.
Study Procedures
Analytical Methods
Mocravimod and mocravimod-phosphate concentrations were determined in whole blood using liquid chromatography coupled to tandem mass spectrometry methods validated with a lower limit of quantification (LLOQ) of 50 pg/mL for mocravimod and 100 pg/mL for mocravimod-phosphate. The upper limit of quantification was 10,000 pg/mL for both mocravimod and mocravimod-phosphate (bioanalytical conduct done by SGS France).
Pharmacokinetics
Blood PK parameters were estimated using noncompartmental methods with Phoenix WinNonlin version 8.4 (Pharsight Corporation, Mountain View, CA). Actual sampling times were used and values below the LLOQ were considered missing.
PK parameters included Cmax; apparent half-life (t1/2), time to reach Cmax (Tmax), and CL/F (apparent clearance). Area under the blood concentration time curve from time 0 to time infinity (AUC0-inf) was calculated using population PK modeling. Blood concentrations and PK parameters were listed and summarized by treatment using descriptive statistics (N, mean, standard deviation [SD], median, Q1, Q3, min, max, geometric mean, and coefficient of variation [CV%]).
Safety
In both studies, safety was evaluated by assessment of clinical laboratory test results including lymphocyte sample collection, electrocardiograms (ECGs) and pulse rate, periodic physical examinations, vital signs measurement, and by documentation of adverse events (AEs). AEs were coded per Medical Dictionary for Regulatory Activities, version 26.0.
In addition, concomitant medications were recorded throughout the study. Safety data were listed and summarized descriptively per treatment.
Pharmacodynamics
Heart rate measurements were assessed in the itraconazole DDI study at the following time points: period1: day-1, day 1 pre-dose, 1 h post dose, 6, 12, 24 (day 2), and 48 h (day 3), then on day 5, 7, 9, 11, and 14 in the morning; period 2: day-1, day 5 pre-dose, 1 h post dose, 6, 12, 24 (day 6), and 48 h (day 7) then on day 9, 11, 13, 15, 18, and 20 in the morning.
Heart rate measurements were assessed in the cyclosporin DDI study at the following time points: period 1: day-1, day 1 pre-dose, 0.5, 1, 1.5, 2, 3, 4, 6, 8, 10, and 12 h post-dose, and then 24 h (day 2), 48 h (day 3) then on day 5 until day 14 in the morning; period 2: day-1, day 2 pre-dose, 0.5, 1, 1.5, 2, 3, 4, 6, 8, 10, and 12 h post-dose, then 24 h (day 3), and 48 h (day 4) then on day 5 until day 17 in the morning. All vital signs measurements were conducted in supine position after the subject had rested for at least 5 min in the supine position. Nadir of heart rate (PRnadir(0-24)) and area under the effect curve (AUE(0-24)PR) were calculated based on trapezoidal rule on nominal times per individual.
Statistical Analysis
The statistical analyses were performed using SAS software version 9.4 (SAS Institute Inc., Cary, NC, USA). PK parameters after administration of mocravimod and mocravimod-phosphate measured in presence and in absence of itraconazole or cyclosporin was analyzed in agreement with the FDA guidance document.11 The effect of concomitant administration of mocravimod with itraconazole or cyclosporin was assessed using the geometric mean ratio and 90% confidence intervals (CIs) of mocravimod and mocravimod-phosphate blood PK parameters Cmax and AUC0-inf. A linear mixed model with a fixed effect for treatment and a random effect for subject was used for natural log-transformed Cmax and AUC0-inf. Geometric leastsquares means were provided for each treatment. In all comparisons, mocravimod administered alone was used as the reference. For the interferential analysis of safety data, the comparison between mocravimod and mocravimod + cyclosporin was conducted. The PR parameters (PRnadir(0-24) and AUE(0-24)PR), parameters in the cyclosporin DDI study were analyzed by arithmetic means of a mixed effects model, and included treatment as factor, pre-dose value as covariate and subject as a random effect. The mean was estimated for each treatment group. The mean differences between treatment means, was also estimated, along with its 90% CI.
Population Pharmacokinetic Modeling
Due to the long half-life of mocravimod and mocravimod-phosphate,12 the observation time was not considered sufficient to estimate the AUC0-inf reliably (>20% extrapolation of AUCtau to AUC0-inf) by non-compartmental analysis (NCA). Therefore, the analysis and interpretation of the study results was supported by population PK modeling in addition to the NCA. Mocravimod and mocravimod-phosphate were described by two separate population PK models based on historical data in healthy subjects. The PK models comprised of a linear two compartmental distribution model, zero order with lag time followed by first order (ka) absorption into the central compartment. For mocravimod, bodyweight was a covariate on ka, apparent compartment volume and CL/F. Prandial state increased ka and decreased relative bioavailability. For mocravimod-phosphate, bodyweight was a covariate on central volume of distribution. Prandial state decreased zero order absorption and decreased relative bioavailability. Models were built with a fixed inter-individual variability (IIV) of 0.5 and 1 to allow for an appropriate characterization of individual concentration-time profiles, given the high variability observed in the data due to the impact of cyclosporin and itraconazole on mocravimod concentration-time profiles. Then, the IIV was attempted to be estimated based on the healthy subjects DDI data.Afterwards, the IIV of some parameters was fixed and for certain parameters it was estimated based on the information content of the data. The estimation of individual PK parameters was conducted for all subjects who completed at least period 1 of the studies based on the previously developed pop-PK models for mocravimod and mocravimod-phosphate. AUC0–inf was derived based on estimated individual PK parameters of mocravimod and mocravimod-phosphate in the absence and presence of co-medication.
In case a relevant PK interaction was found based on GMR result, further exploratory covariate analyses would be conducted. Therefore, the impact of itraconazole and cyclosporin on relative bioavailability, absorption, and clearance was explored to evaluate the potential role of CYP3A4, P-gp, and BCRP inhibition by means of covariate population PK modeling.13 This exploratory evaluation and quantification of the net effect of CYP3A4, P-gp, or BCRP inhibition on PK parameters were conducted in a step-wise approach. Firstly, the relationship between individual random effects after dosing of mocravimod and mocravimodphosphate in absence and presence of cyclosporin and itraconazole were explored in a graphical exploratory analysis. Secondly, if trends and correlations between estimated individual random effects of mocravimod and mocravimod-phosphate in the absence and presence of cyclosporin/itraconazole were detected, exploratory covariate model development was performed. Following the assumption that itraconazole is a P-gp and CYP3A4 inhibitor, whilst cyclosporin is inhibiting P-gp, CYP3A4, and BCRP,14 covariate effects on clearance and absorption were considered. The presence/absence of itraconazole/cyclosporin was modeled as a categorical covariate. Per default, itraconazole was considered as a covariate, which is not time-varying over the time-course that follows a dosing event. As the data exploration did not indicate that the inhibitory effects of cyclosporin drop significantly in a phase where the elimination of mocravimod and mocravimod-phosphate is still substantial, cyclosporin as time-invariant covariate was used.
Non-linear mixed effects modeling (NONMEM) (version 7.5.1) was used. The “stochastic approximation expectation maximization” (SAEM) method in NONMEM was used as the main parameter estimation algorithm. After each SAEM estimation step, the objective function was determined using importance sampling with the setting EONLY = 1 and MAPITER = 0, as suggested in [ICON 2017].15
Results
Subject Disposition and Baseline Characteristics
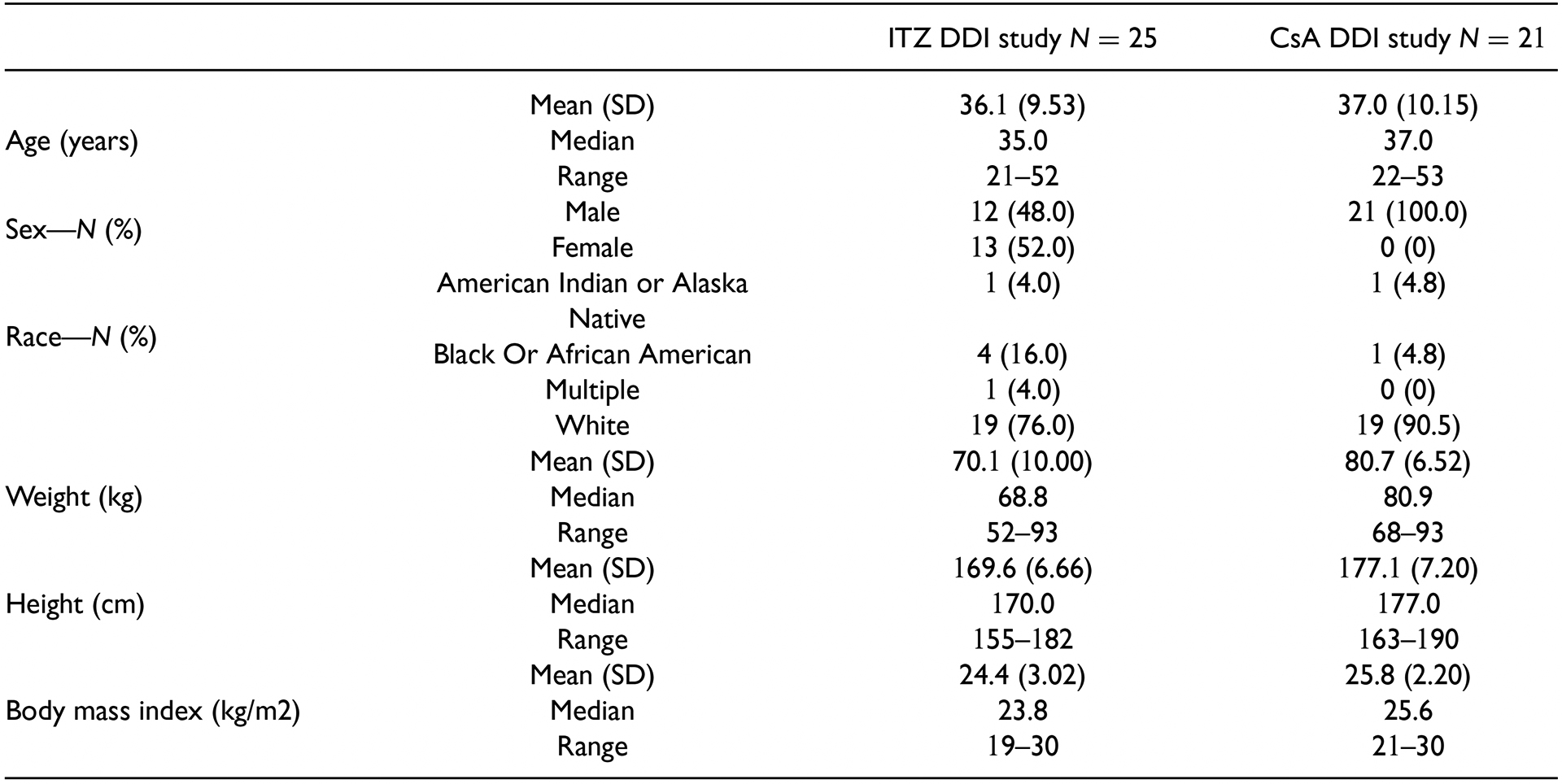
Baseline characteristics of subjects from each study are shown in Table 1. In total, 46 subjects were enrolled. Baseline characteristics were typical for a healthy population.
In the itraconazole DDI study, 6 subjects discontinued the study. Five of these subjects discontinued during the first administration of mocravimod 3 mg; 3 due to AEs and 2 for personal reasons. One subject discontinued later in the study due to personal reasons.
In the cyclosporin DDI study only males were enrolled. Out of the 21 subjects, two discontinued the study, one due to an AE considered related to mocravimod and one due to failure to meet continuation criteria before the second period.
Pharmacokinetics
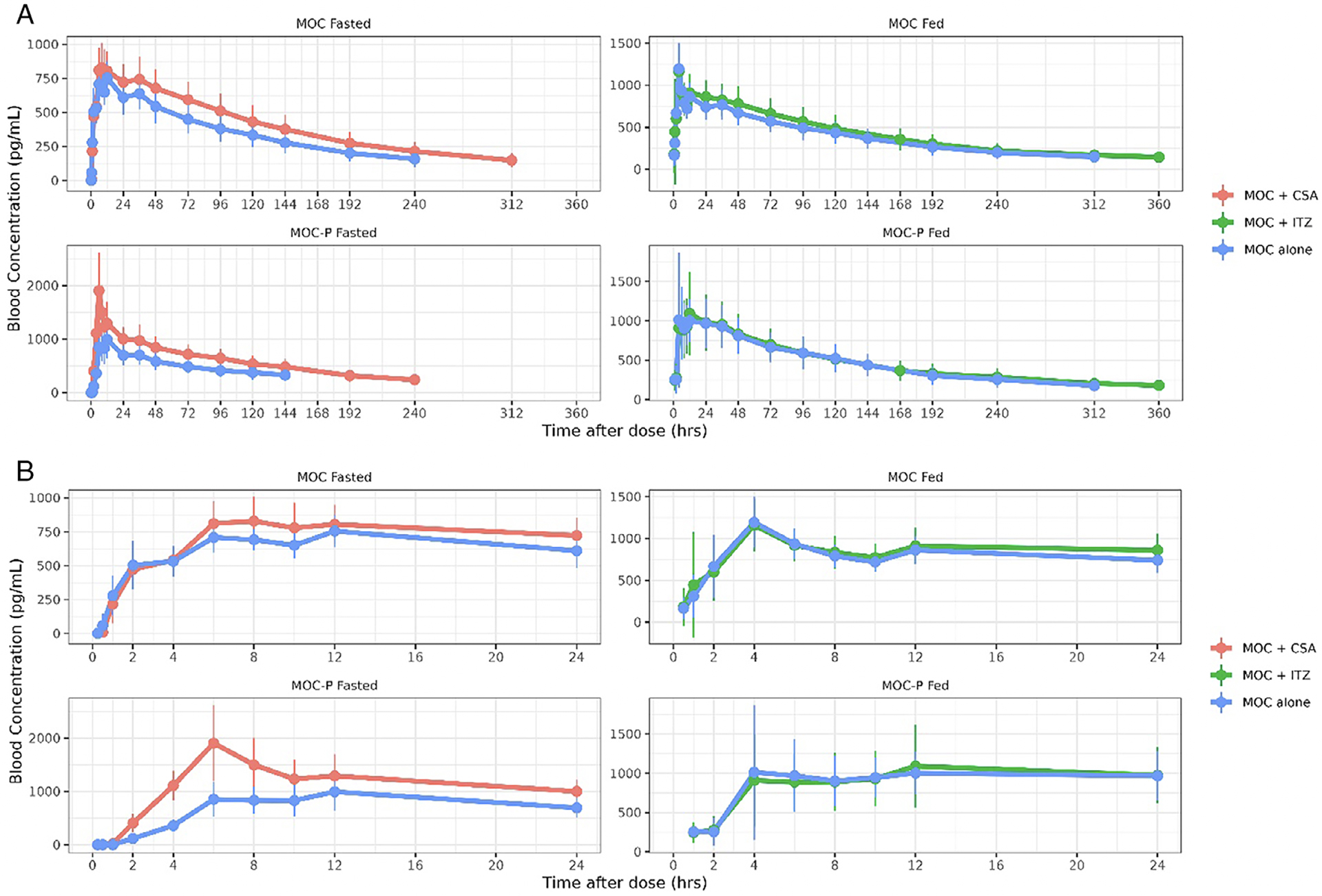
The full blood concentration–time curves of the itraconazole DDI study are shown in Figure 1A, while the details on absorption profiles are displayed in Figure 1B. Overall, mean mocravimod and mocravimod-phosphate blood concentrations were similar when mocravimod was co-administered with itraconazole compared to mocravimod administered alone. Visual inspection of the blood concentration time profiles showed similar mean blood concentrations of mocravimod and mocravimod-phosphate between both periods. These results were confirmed by NCA and popPK results of PK parameters (Tables S1 and S2).
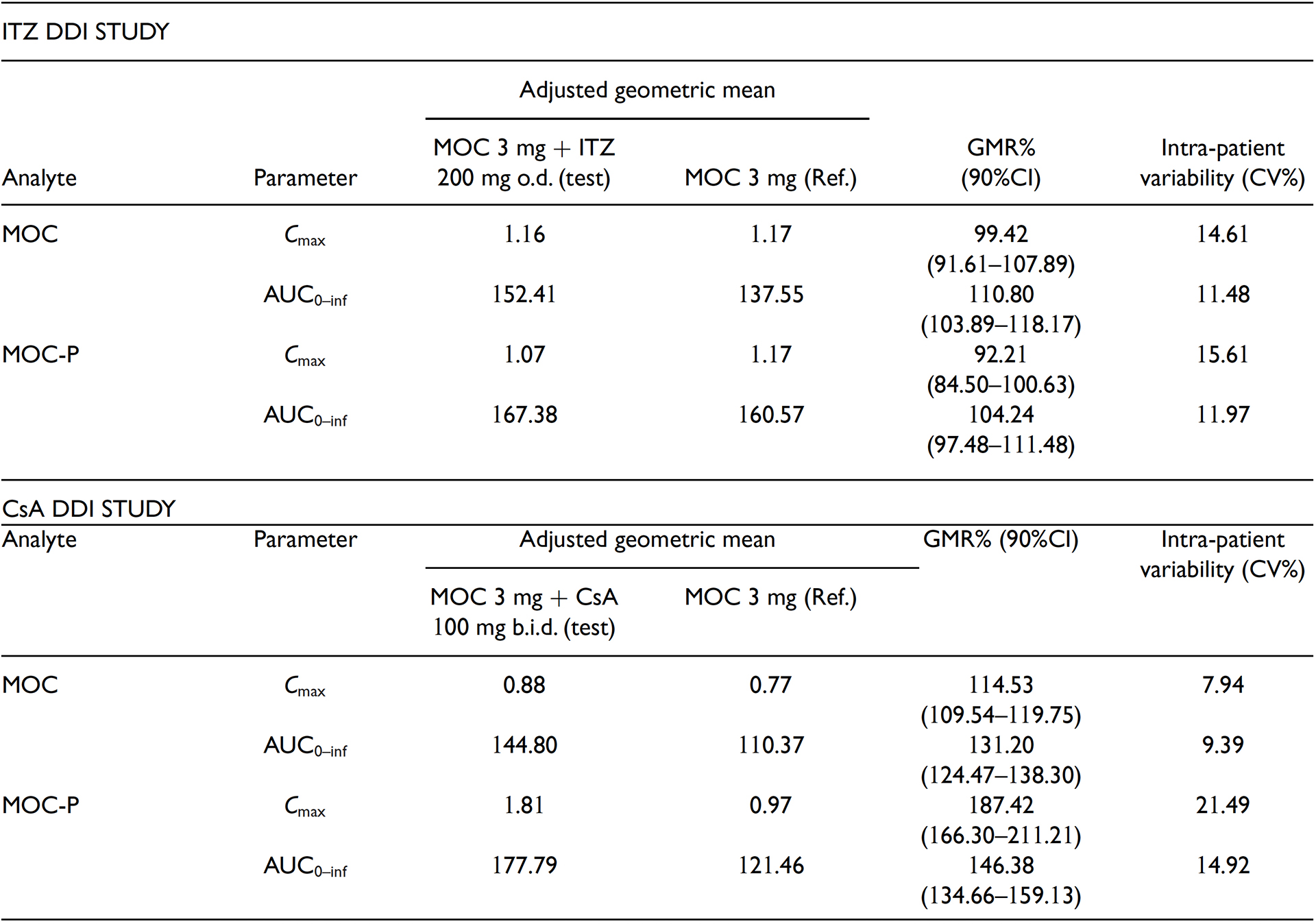
After coadministration with cyclosporin, the 90% CI of the estimated GMR for mocravimod Cmax was contained within the regulatory limits (>80.00% and <125.00%); the effect of cyclosporin co-administration was minor (Cmax 1.15-fold higher) (Table 2).
However, the 90% CIs of the estimated GMR for mocravimod AUC0-inf, mocravimod-phosphate Cmax, and mocravimod-phosphate AUC0–inf were not contained within the regulatory equivalence limits (>125.00%), with a 1.31-fold, 1.87-fold, and 1.46-fold increase, respectively, when cyclosporin was co-administrated (Table 2).
Table 1. Demographics and baseline characteristics of enrolled subjects in the ITZ and CsA DDI studies.
CsA: cyclosporine; DDI: drug–drug interaction; ITZ: itraconazole; N: number of subjects; SD: standard deviation.
Based upon the GMR results, the effect of covariates upon the interaction between cyclosporin and mocravimod required further investigation.
The covariate effect of cyclosporin on clearance and zero-order bioavailability (Fabs0) was evaluated for mocravimod (Table S3). The mocravimod model with cyclosporin effect on Fabs0 resulted in the best Bayesian information criterion value and it was possible to estimate the covariate effect adequately (see model 3, Table S3). The estimated value of the relative bioavailability under the influence of cyclosporin coadministration was increased by an approximate 18% (95% confidence interval: 8% to 29%) for mocravimod.
For mocravimod-phosphate, the effect of cyclosporin on relative bioavailability and the time of the zero-order transfer process were evaluated. The estimated effect of cyclosporin on the bioavailability is ∼59%. However, the model showed instability in the trajectories of the objective function value and the estimated effect is higher than suggested by the bioequivalence testing (results not shown).
Figure 1. (A) Arithmetic mean (±SD) blood concentration-time profiles of MOC and MOC-P after administration of 3 mg MOC alone or in combination with 200 mg itraconazole o.d. (N = 19) or in combination with 100 mg cyclosporine b.i.d. (N = 19). Full concentration time profiles are displayed. (B) Arithmetic mean (±SD) blood concentration-time profiles of MOC and MOC-P after administration of 3 mg MOC alone or in combination with 200 mg itraconazole o.d. (N = 19) or in combination with 100 mg cyclosporine b.i.d. (N = 19). Absorption profiles in detail.
Safety and Tolerability
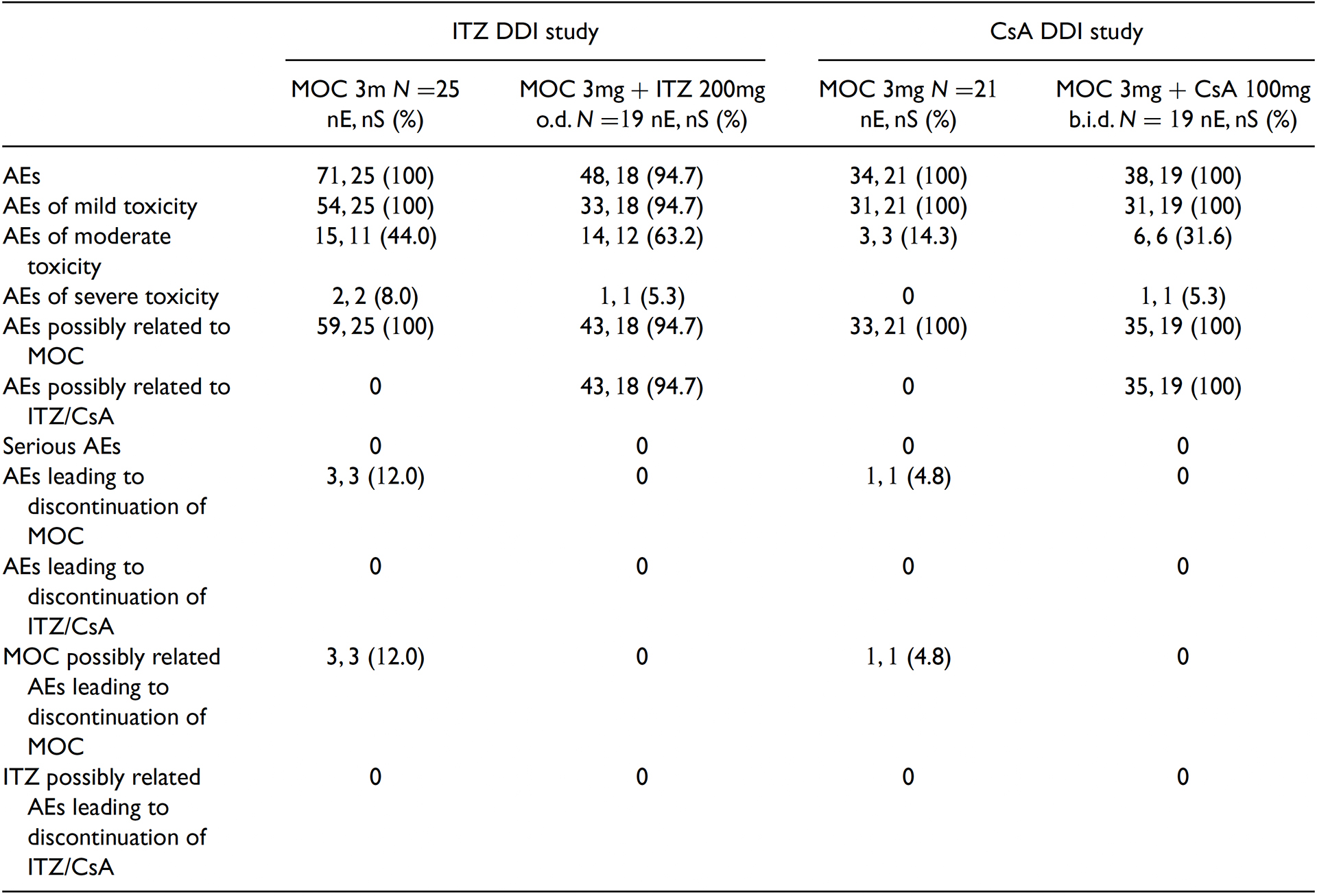
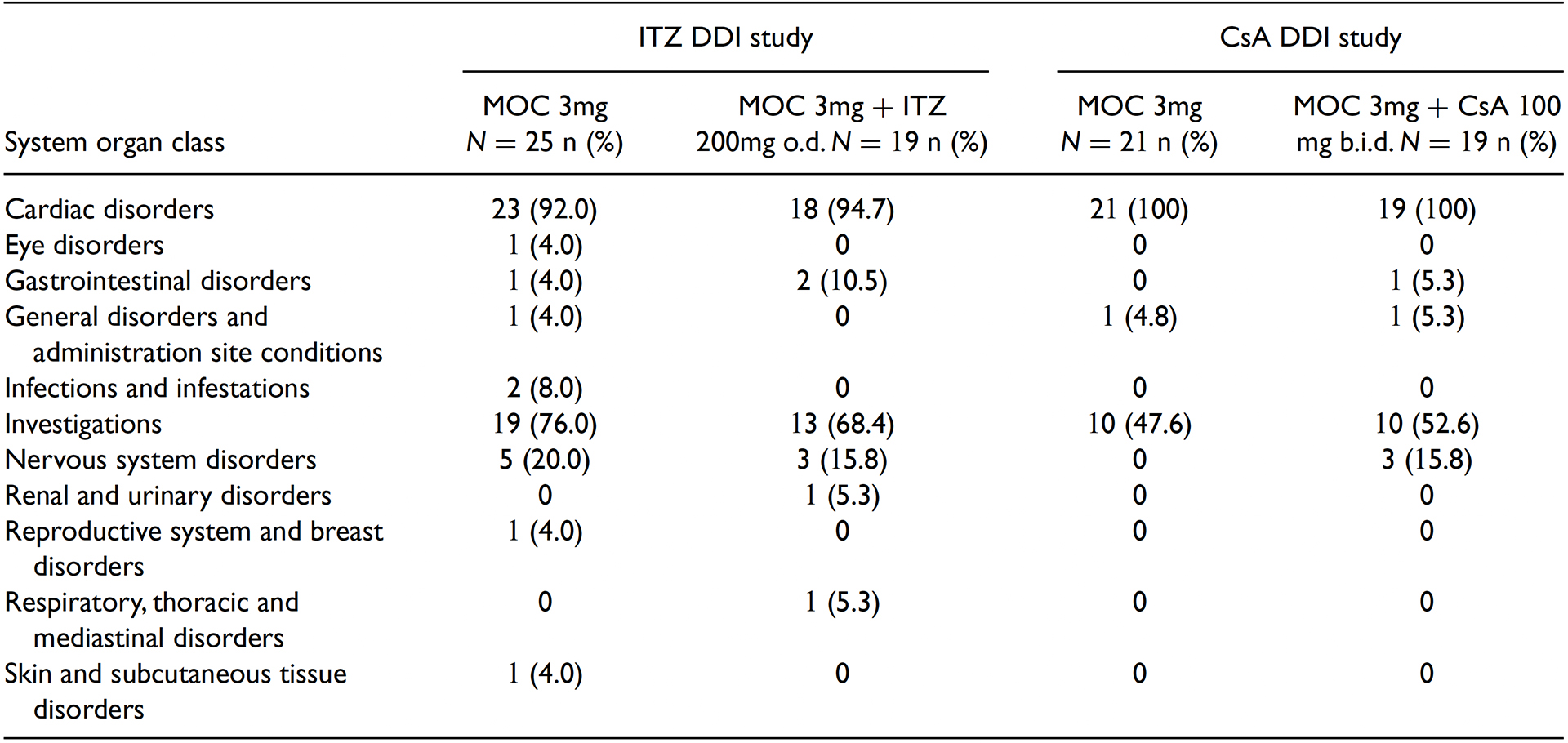
No SAEs (serious adverse events) or deaths were reported in these two studies. The overall incidence of TEAEs (treatment emergent adverse events) and TEAEs by system organ class are displayed in Tables 3 and 4, respectively.
In the itraconazole DDI study, three subjects withdrew from the study due to AEs of arrhythmia supraventricular, atrioventricular block second degree, and lymphocyte count decreased. The majority of TEAEs in both periods were of mild or moderate toxicity grade (Grade 1 or 2). Three AEs of lymphocyte count decreased were reported as severe (Grade 3) toxicity grade by 2 (8.0%) subjects in the mocravimod 3 mg period and 1 (5.3%) subject in the mocravimod 3 mg + itraconazole 200 mg o.d. period.
During the mocravimod 3 mg period, 25 subjects (100%) had TEAEs that were considered possibly drug-related (arrhythmia supraventricular [1 subject], atrioventricular block first degree [7 subjects, 28%], atrioventricular block second degree [1 subject, 4%], bradycardia [22 subjects, 88%], chest discomfort [1 subject, 4%], lymphocyte count decreased [19 subjects, 76%], and dizziness postural [1 subject, 4%]). During the mocravimod 3 mg + itraconazole 200 mg o.d. period, 18 subjects (94.7%) had TEAEs that were considered as being possibly drugrelated (atrioventricular block first degree [4 subjects, 21%], bradycardia [16 subjects, 84%], lymphocyte count decreased [13 subjects, 68%], dizziness [1 subject, 5%], and headache [1 subject, 5%]). All TEAEs were recovered without sequelae except for one TEAE of itchy nipples which was considered as being not related to study treatment. This event was observed to be recovering/resolving at the EOS visit. Additionally, one TEAE of mild bradycardia was recovered/resolved with sequelae (low pulse rate) at the EOS visit.
No clinically relevant findings were reported from physical examination, vital signs, ECG, and laboratory values except for lymphocyte count and pulse rate where relevant changes were noted in both periods.
In the cyclosporin DDI study, 1 subject withdrew from the study due to an AE of atrioventricular block second degree, considered possibly related to mocravimod. The majority of TEAEs in both periods were of mild or moderate toxicity grade (grade 1 or 2). One AE of “lymphocyte count decreased” was reported as severe (grade 3) toxicity grade in the mocravimod 3 mg + cyclosporin 100 mg twice daily period. During the mocravimod 3 mg period, 21 subjects (100%) had TEAEs that were considered possibly drug-related (atrioventricular block second degree [1 subject, 5%], bradycardia [21 subjects, 100%], asthenia [1 subject, 5%], and lymphocyte count decreased [9 subjects, 43%]). During the mocravimod 3 mg + cyclosporin 100 mg twice daily period, 19 subjects (100%) had TEAEs that were considered possibly drug-related (atrioventricular block first degree [1 subject, 5%], bradycardia [19 subjects, 100%], headache [3 subjects, 16%], soft feces [1 subject, 5%], and lymphocyte count decreased [10 subjects, 53%]). All TEAEs were recovered/resolved without sequelae by the EOS visit.
AUC0-inf: area under the blood concentration time curve from time 0 to time infinity; b.i.d.: twice daily; Cmax: maximum blood concentration; CI: confidence interval;CsA: cyclosporine; CV%: coefficient of variation; DDI: drug–drug interaction; GMR: geometric mean ratio; ITZ: itraconazole;MOC: mocravimod;MOC-P:mocravimod-phosphate; o.d.: once daily.
No clinically relevant findings were reported from physical examination, vital signs, ECG, and lab data except for lymphocyte count and pulse rate where relevant changes were noted in both periods.
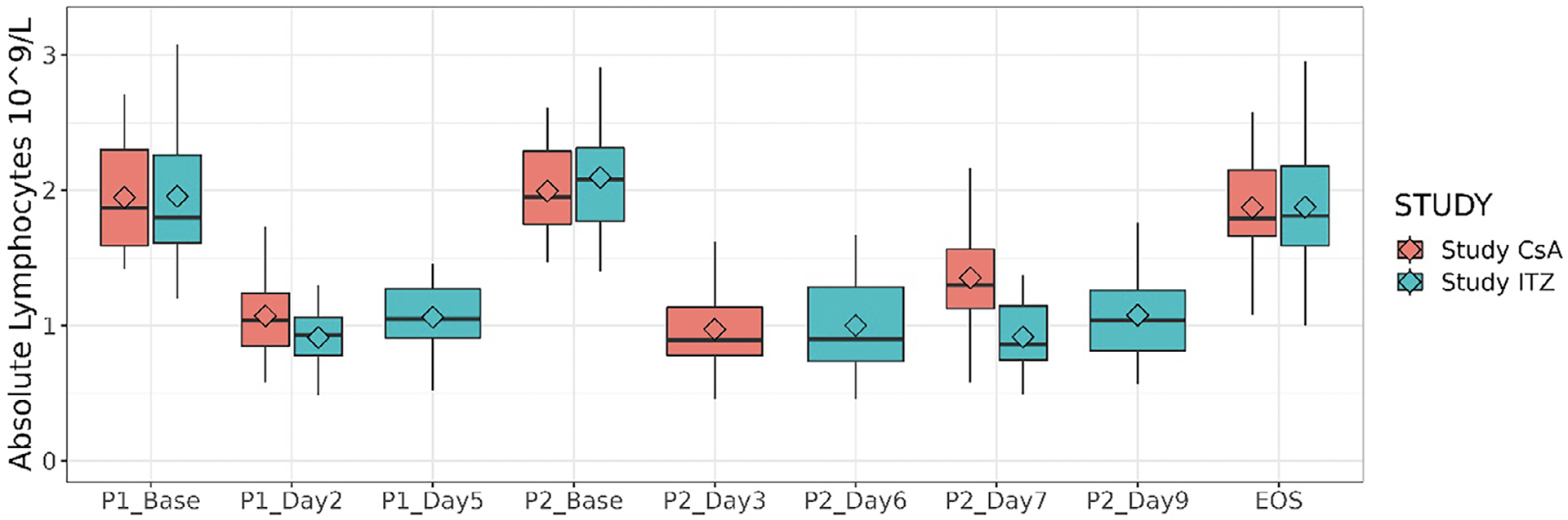
Absolute Lymphocyte Reduction. In the itraconazole DDI study, at Baseline for period 1, median (range) lymphocytes were 1.80 (1.2 to 3.1) × 109/L. At P1D2 median lymphocytes were 0.93 (0.5 to 1.3) × 109/L. At P1D5 (period 1, day 5), median lymphocytes were 1.05 (0.5 to 1.5) × 109/L. At Baseline for period 2, median (range) lymphocytes were 2.08 (1.4 to 2.9) × 109/L, with a lower value of 0.86 (0.5 to 1.4) × 109/L at P2D7.
In the cyclosporin DDI study, at baseline for period 1, median (range) lymphocytes were 1.870 (1.42 to 2.71) × 109/L. At P1D2 median lymphocytes dropped to 1.040 (0.58 to 1.73) × 109/L. At baseline for period 2, median (range) lymphocytes were 1.950 (1.47 to 2.61) × 109/L, with a lower value of 0.890 (0.46 to 1.62) × 109/L at P2D3. Median lymphocyte levels returned to baseline levels by EOS. Figure 2 illustrates the changes in absolute lymphocyte count for both studies.
Pharmacodynamics
The effect on the heart rate reduction after mocravimod administration was also investigated in the cyclosporin DDI. The arithmetic means of supine heart rate for the first 24 h post-dose in the cyclosporin DDI Study are displayed in Figure S3. Some variability can be seen with and without cyclosporin co-administration. A summary of descriptive supine heart rate parameters in the cyclosporin DDI Study is presented in Table S4. The effect of co-administration of cyclosporin on top of mocravimod showed a small difference in PRnadir (nadir of heart rate) of −0.58 (90%CI −1.66 to 0.50) bpm, indicating lack of additional effect of combination treatment. In contrast to the AUE0-24, (area under the effect curve from 0 to 24 h) where a 13.96 (h*bpm) (90% CI −18.89 to 46.82) difference was found for mocravimod alone. However, given the large spread of 90% CI, these results should be interpreted with caution. Both parameters do not show increased risk of heart rate reduction in combination with cyclosporin.
Figure 2. Lymphocytes count (×109/L). ITZ DDI study (N = 25), CsA DDI study (N = 21)
Table 3. Overall incidence of treatment-emergent adverse events.
AE: adverse event; b.i.d.: twice daily; CsA: Cyclosporine; DDI: drug–drug interaction; ITZ: itraconazole;MOC:mocravimod; o.d.: once daily.
N = number of subjects studied.
nE = number of AE events in the category.
nS = number of subjects with at least one AE in the category.% is based on the number of subjects.
treatment-emergent is defined as an AE that started after the first dose of each period up to 27 days (ITZ DDI Study) or 49 days (CsA DDI Study) after the last actual administration of each period (and before the start of period 2 for period 1).
AE: adverse event; b.i.d.: twice daily; CsA: cyclosporine; DDI: drug–drug interaction; ITZ: itraconazole;MOC:mocravimod; o.d.: once daily.
N = number of subjects studied.
A subject with multiple AEs is counted only once in the “any system organ class” row.
A subject with multiple AEs within a primary system organ class is counted only once for that system organ class & treatment.
Treatment-emergent is defined as an AE that started after the first dose of each period up to 27 days (ITZ DDI Study) or 49 days (CsA DDI Study) after the last actual administration of each period (and before the start of period 2 for period 1).
Discussion
A wide range of drug-metabolizing enzymes, as well as drug transporters, have been implicated as causes of clinically significant drug interactions resulting in hospitalization. An important aspect of drug development is to determine the DDI potential early in the development process to avoid serious, potentially life-threatening complications. In vitro studies have suggested that CYP3A4 is the primary enzyme involved in metabolism and that both mocravimod and mocravimod-phosphate are substrates for BCRP and P-gp. As CYP3A4 inhibitors (e.g. azoles and cyclosporin) are frequently administered as SoC medications to allo-HCT patients, the potential for DDIs with itraconazole (a strong CYP3A4 inhibitor) and cyclosporin (moderate CYP3A4 inhibitor and P-gp, BCRP, and OATP inhibitor) was evaluated.
Co-administration of itraconazole and mocravimod did not have a significant impact on the exposure of mocravimod and mocravimod-phosphate, while co-administration of cyclosporin and mocravimod resulted in a moderate increase in exposure of mocravimod (1.15-fold higher for Cmax and 1.31-fold higher for AUC0-inf) and its active metabolite (1.87-fold higher for Cmax and 1.46-fold higher for AUC0-inf). An effect of cyclosporin on CYP3A4 metabolism is unlikely based on no observed effect on the elimination phase, (i.e. CL/F) parameter. The observed effects of cyclosporin on the absorption phase of mocravimod and mocravimod-phosphate suggests an underlying inhibition of BCRP rather than an effect of CYP3A4. Inhibition of this transporter can explain the reduced mocravimod and mocravimod-phosphate elimination via the bile and feces, resulting in increased blood concentration and exposure of mocravimod and mocravimod-phosphate in the presence of cyclosporin. However, the mocravimod and mocravimod-phosphate increase in exposure in presence of cyclosporin was not as high as expected (i.e. 2-2.5-fold increase expected based on sparse PK data in a few patients dosed with cyclosporin and mocravimod). Population and PBPK analyses in a much larger dataset/number of patients are needed to elucidate the potential covariates that could explain the higher magnitude of the interaction, for example the number of comedications in all-HCT trials and health condition of the patients. A limitation of the current study design was the single dose administration of mocravimod however, it does not show time-dependent or concentration dependent pharmacokinetics that require a more complex study design with multiple dosing of victim and perpetrator. The current design was chosen to reflect the inhibition of concomitant medication use on the mocravimod exposure. In patient trials, mocravimod reached steady state after approximately a month. Study designs with loading doses to reach steady state earlier are not feasible as mocravimod has an effect on bradycardia after the first doses which is also dose dependent. Therefore, the current design was fit for purpose, in combination with the initial clinical results to answer the question of relevance of a drug–drug interaction.
Additional PBPK modeling would be advantageous given the opportunity to simulate various scenarios related to the complex AML patient population and co-medications used for all-HCT. Unfortunately, informative pre-clinical and pre-clinical data to support development and validation of such model, are not yet available or being generated.
Although the DDI study of mocravimod and cyclosporin was conducted exclusively in male subjects, the results are considered applicable to females, as sex has not been identified as a covariate affecting the pharmacokinetics of either mocravimod or cyclosporin.
The structural models from previous mocravimod and mocravimod-phosphate population PK models were used to derive the individual fits of the DDI studies. Due to the limited number of subjects, IIV could not be estimated on all parameters. However, based on the good individual fits, this presumably did not impact the adequacy of the obtained individual fits.
The parameters relative bioavailability and apparent clearance, which finally determine the AUC0-inf, had very limited shrinkage indicating the reliability of the estimated individual parameters, based on which the AUC0-inf was derived. Hence, the population PK modeling allowed for a reliable characterization of the individual exposures required for determination of the geometric mean ratio for the AUC0-inf.
In a subsequent step, covariate modeling was explored on the PK parameters. The goal of the covariate modeling was to build a model that is able to quantify the co-medication effect on the parameters, given the quality and quantity of data of both studies. Therefore, the previous mocravimod and mocravimod-phosphate models were simplified. As the visualization of the absorption phase revealed that the fed subjects have larger mocravimod and mocravimod-phosphate concentrations than the fasted ones, the covariate effect of the fasted prandial state on relative bioavailability for mocravimod, and on relative bioavailability and lag time for mocravimod-phosphate were quantified. Moreover, it was found that for mocravimod, cyclosporin increases relative bioavailability. The effects of cyclosporin on relative bioavailability that were quantified in the covariate modeling for mocravimod
are in line with the results from the bioequivalence testing. As mocravimod is the parent compound and mocravimod-phosphate is the metabolite, thus mocravimod converts to mocravimod-phosphate, it implies that the covariate effect of cyclosporin on relative bioavailability observed for mocravimod is present for mocravimod-phosphate as well. Additional clinical PK data would be needed to stabilize the model for mocravimod-phosphate to further investigate the covariate effects on the PK parameters. Given the limited drug–drug interaction that was observed, its relevance is minimal and therefore no additional modeling steps were pursued. This will be conducted once a larger dataset in patients is available and PK data can be linked to relevant safety and efficacy to inform decision making on, for example dose selection.
Overall, when compared to mocravimod 3 mg administered alone, mocravimod 3 mg co-administered with itraconazole 200 mg o.d. or cyclosporin 100 mg twice daily. had a comparable safety profile. The mostcommonly reported AEs, (bradycardia, decreased lymphocyte count) were consistent with the known adverse reaction of mocravimod 3 mg. A decreased lymphocyte count was expected based on the known characteristic of mocravimod leading to egress of lymphocytes into secondary lymphoid organs and reducing blood lymphocyte counts. This is known to be caused by functional antagonism at the S1P1 receptor on lymphocytes such as T and B cells because of persistent ligand-induced internalization of the S1P1 receptor. The internalization of S1P1 receptors renders these cells unresponsive to S1P, depriving them of an obligatory signal for egress. No SAEs and no fatal TEAEs were reported during these studies.
Transient bradycardia and atrioventricular (AV) blocks are associated with the class of S1P modulators. Most of the labels of approved S1P1 modulators such as fingolimod, ponesimod, estrasimod and siponimod, show clear guidance on first dose effects on heart rate, monitoring guidelines and treatment initiation recommendations.
Heart rate effect for combination with cyclosporin does not show differences (PRnadir of −0.58 (90%CI − 1.66 to 0.50) bpm). Reduction in heart rate is similar to observed changes in heart rate for other S1P modulators such as siponimod or fingolimod.16 The maximum heart rate effect of the active treatment relative to placebo at doses producing approximately 70% reduction in absolute lymphocyte counts varied across molecules and ranged from approximately −21 to −6.5 bpm for siponimod and −11 to −6 bpm for fingolimod.16
These results are comparable with the first dose reduction in heart rate observed for several S1P1R modulators.16
Conclusion
Co-administration of itraconazole, a strong CYP3A4 inhibitor, and mocravimod did not have a significant impact on the exposure of mocravimod and mocravimod-phosphate, while co-administration of cyclosporin, a BCRPand CYP3A4 inhibitor, and mocravimod resulted in a moderate increase in exposure of mocravimod. The observed effects of cyclosporin on the absorption phase of mocravimod suggests an underlying inhibition of BCRP transporters.Mocravimod can be co-administered with CYP3A4 inhibitors such as anti-fungal azoles or BCRP/CYP3A4 inhibitors such as cyclosporin without the need for dose adjustments.
Acknowledgments
We thank Laure Viguerie (Venn Life Sciences) and Astrid Trion (Venn Life Sciences) for their assistance with preparation of the manuscript. We thank Intiquan AG for their support of the population PK analysis.
Author Contributions
All authors have made substantial contributions to the conception and design of the study, acquisition of data, or analysis and interpretation of data. They have been involved in drafting the manuscript or revising it critically for important intellectual content, have given final approval of the version to be published, and have agreed to be accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Conflicts of Interest
All authors are employees of Priothera SAS.
Funding
These studies were funded by Priothera SAS.
Data Availability Statement
Priothera SAS will provide access to individual deidentified participant data upon request. To gain access, data requestors must enter into a data access agreement with Priothera SAS.
Ethics Statement
The study protocols, amendments, and informed consent forms were reviewed by an independent ethics committee (Ethic Committee of Ile-de-France VII). These studies were conducted in accordance with the ethical principles in the Declaration of Helsinki and are consistent with International Conference on Harmonisation, Good Clinical Practice and applicable regulatory requirements. All subjects provided written informed consent for study participation before any procedures were performed.
References
- Sureda A, Corbacioglu S, Greco R, et al., editors. The EBMT Handbook: Hematopoietic Cell Transplantation and Cellular Therapies. 8th ed. Springer; 2025.
- Song J, Matsuda C, Kai Y, et al. A novel sphingosine 1-phosphate receptor agonist, 2amino-2-propanediol hydrochloride (KRP-203), regulates chronic colitis in interleukin-10 gene-deficient mice. J Pharmacol Exp Therap. 2008. 324(1):276-283.
- Krauser JA, Jin Y, Walles M, et al. Phenotypic and metabolic investigation of a CSF-1R kinase receptor inhibitor (BLZ945) and its pharmacologically active metabolite. Xenobiotica. 2015. 45(2):107-123.
- U. S. Food and Drug Administration: Clinical drug interaction studies: cytochrome P450 enzyme- and transporter-mediated drug interactions guidance for industry. January 2020. Accessed August 20, 2025. https://www.fda.gov/drugs/guidance-complianceregulatory-information/guidances-drugs
- European Medicines Agency: Guideline on the investigation of drug interactions, CPMP/EWP/560/95/Rev.1 Corr. 2. January 1, 2013.Accessed August 20. 2025. https://www.ema.europa.eu/en/investigation-druginteractions-scientific-guideline
- Peng Y, Cheng Z, Xie F. Evaluation of pharmacokinetic drug–drug interactions: a review of the mechanisms, in vitro and in silico approaches. Metabolites. 2021;11(2):75.
- U. S. Food and Drug Administration: GILENYA (fingolimod) capsules, for oral use initial U.S. Novartis. 2010. AccessedAugust 20, 2025. https://www.accessdata.fda.gov/drugsatfda_docs/label/2010/022527s000lbl.pdf
- Summary of product characteristics Sporanox® 100 mg capsule from résumé des caractéristiques du produit – SPORANOX 100 mg, gélule – base de données publique des médicaments (medicaments.gouv.fr). Accessed August 20, 2025. https://base-donnees-publique.medicaments.gouv.fr/medicament/62469613/extrait
- Liu L, Bello A, Dresser MJ, et al.: Best practices for the use of itraconazole as a replacement for ketoconazole in drug–drug interaction studies. J Clin Pharmacol. 2016. 56(2):143-151.
- Summary of product characteristics NEORAL® from résumé des caractéristiques du produit – NEORAL 100 mg, capsule molle – base de données publique des médicaments (medicaments.gouv.fr). Accessed August 20, 2025. https://base-donnees-publique.medicaments.gouv.fr/medicament/67194943/extrait
- U. S. Food and Drug Administration: Statistical approaches to establishing bioequivalence. February 2001. Accessed August 20, 2025. https://www.fda.gov/regulatory-information/searchfda-guidance-documents/statistical-approachesestablishing-bioequivalence
- Svensson EM, C Acharya, B Clauson, et al. Pharmacokinetic interactions for drugs with a long half-life – evidence for the need of model-based analysis. AAPS J. 2016. 18(1):171-179.
- Xu XS, Yuan M, Zhu H, et al. Full covariate modelling approach in population pharmacokinetics: understanding the underlying hypothesis tests and implications of multiplicity. Br J Clin Pharmacol. 2018; 84: 1525-1534.
- Lin J.H, Yamazaki M. Role of P-glycoprotein in pharmacokinetics. Clin Pharmacokinet. 2003; 42(1): 59-98.
- ICON development solutions, NONMEM users guide, introduction to NONMEM. April 7, 2017. Accessed August 20, 2025. https://nmhelp.tingjieguo.com/guides/intro7.pdf
- Bihorel S, Singhal S, Shevell D, et al. Population pharmacokinetic Analysis of BMS-986166, a novel selective sphingosine-1-phosphate-1 receptor modulator, and exposureresponse assessment of lymphocyte counts and heart rate in healthy participants. Clin Pharmacol Drug Dev. 2021;10(1):8-21.
Supplemental Information
Additional supplemental information can be found byclicking the Supplements link in the PDF toolbar or the Supplemental Information section at the end of web-based version of this article.









Recent Comments